图1-2 选择物种
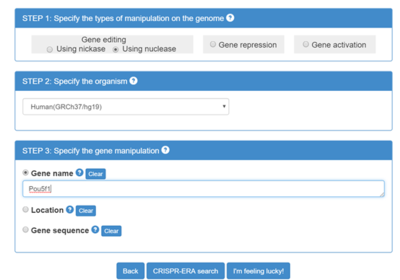
图1-3 选择基因名称。
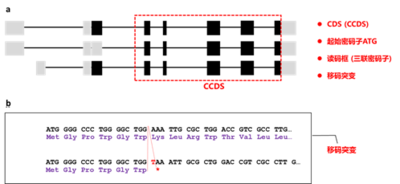
但是出来的sgRNA位置有一些并不总在ATG的下游(图2所示,1,2,6,9,12,16,22几条sgRNA位于ATG的上游)。所以根据位置,对于做基因的敲除(KO)而言,
强烈建议选择
ATG
下游通常
100 aa
以内范围内的
sgRNA
来用(比如图
3
中的
3
,
5
,
7
,
10
等较下游的);而且,一定要位于
CCDS
区域内(
CCDS
是
consensus CDS
,即公共的
CDS
区域,是针对很多个转录本
[isoforms]
定义,图
2
中路色条框即是。这个很重要!!!)。
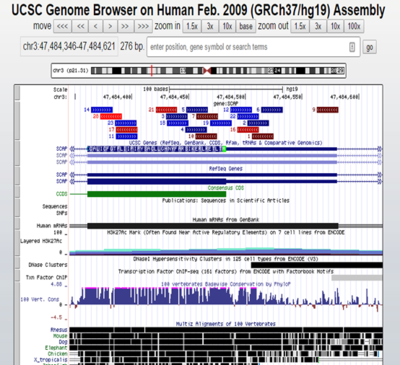
图2
● Feng Zhang lab:
http://crispr.mit.edu/
这是最早的一个设计站点。包括常见的16个物种。选中物种,把你要设计的区段序列扔到下面的框里运行就行。。但前提是你自己已经选好了位置(图3)
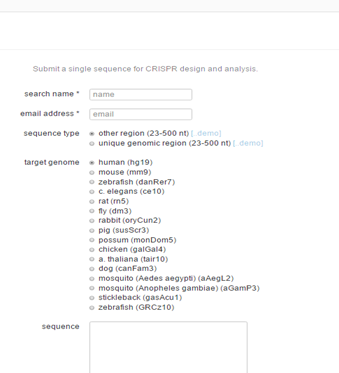
图3
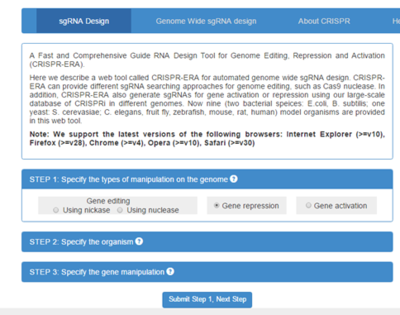
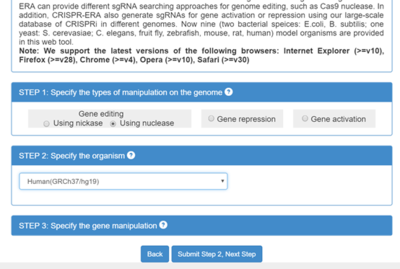
这个站点内容更加丰富,比如物种覆盖式最多的,包括植物,昆虫等等(图4左)。这个站点也是输入目的基因的序列定制的,不同的是可以有较大的自由度选择位置预测。
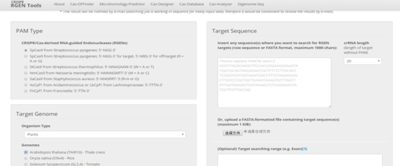
图4
https://apps.thermofisher.com/crispr/index.html#/search
物种较少,商业性目的特别强,了解下即可。
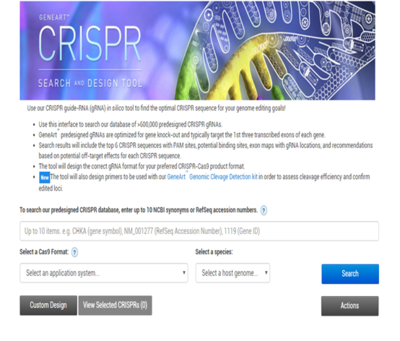
图5
图6
手动版本虽然费事,但有时候却会事半功倍,节约后续鉴定单克隆的成本。我们举例来说:

图7
序列中PAM和sgRNA的序列放大如下(前提是sgRNA位于CCDS区域,而且特异性要保证):

图8
也即我常说的,让Cas9切割位置(确定的)跨过一个酶切位点(比如sfcI)(在前两篇文章中都有所提及)。这样,
在
Cas9成功编辑靶序列产生indels的时候,酶切位点一定会遭到破坏
。
这为后续的单克隆鉴定提供了便利。请看示意图(图9):
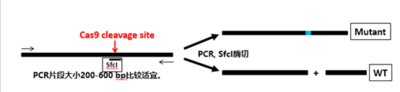
图9
注意一点:
PCR引物设计的时候确保PCR片段内部不要出现第二个SfcI的酶切位点。这样后面酶切的时候结果是唯一的。实验流程和鉴定结果应该是这样的(图10):
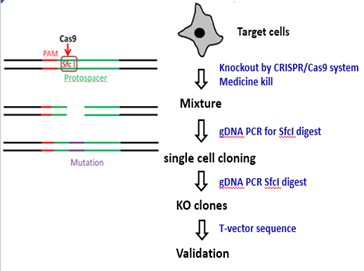
↓
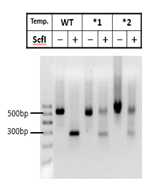
图10
对于WT,酶切是充分的,不会残留。而对于成功编辑的两个mixture:*1和*2,由于产生了indels,部分sfcI的位点造到破坏,sfcI切不动的。对于成功编辑的单克隆而言,应该是一点都切不动。后续鉴定只要这样的克隆去测序即可(图11,红色编号为阳性克隆)。
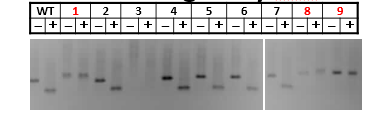
图11
TA克隆结果(图12):

图12
三、其他Cas9,比如Cpf1和saCas9的设计
因为以上介绍的站点没用涉及Cpf1和saCas9,特别是saCas9(非常适合AAV介导的载体基因编辑):
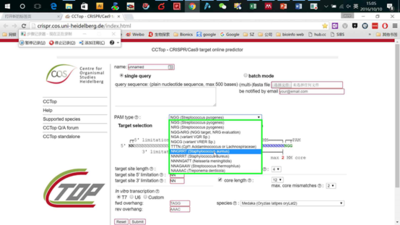
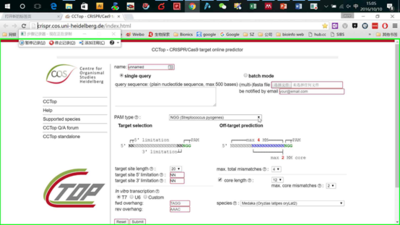
http://crispr.cos.uni-heidelberg.de/index.html
这个网站兼容几乎所有类型的Cas9设计。
打开页面,输入要编辑区域的基因组序列,然后在PAM类型里选择你需要的Cas9类型,比如spCas9,saCas9以及cpf1等。其他条件默认设置即可,然后点击sunmit即可。非常傻瓜式的操作(图13,14)
地址:北京市昌平区沙河镇131号万家灯火创业园A区7309 本网站销售产品仅用于非医疗用途!订购请联系微信、QQ同号:2405919571 微信下单公众号:靖瑞百康生物 电话: