*请参阅我们的 2023 年临床试验回顾
点击此处
.
随着最近的热议
CRISPR
临床试验,我们认为是时候进行全面的状态更新了! 跟踪所有不同的试验可能很困难,特别是因为随着研究人员测试不同的治疗方法,许多相同的疾病出现在新闻中。 在这篇文章中,我将向您介绍临床试验的基础知识,然后从疾病背景到进展更新以及我们真正希望从这些试验中学到什么,绘制出当前基于 CRISPR 的试验。
临床试验基础
在美国,食品和药物管理局 (FDA) 通过以下方式测试新的疾病治疗方法的安全性和有效性
临床试验
在病人志愿者身上。 早期试验着眼于安全性和副作用,而后期试验则测试疗效并将新疗法与标准疗法进行比较
s.
目前使用 CRISPR 疗法的试验都处于早期阶段。 这意味着即使他们成功了,他们可能离 FDA 批准还有几年的时间。
三个治疗领域的临床试验正在进行中:
癌症
、血液病和眼病。 当前所有的 CRISPR 临床试验都旨在在不影响精子或卵子的情况下编辑特定组织,这意味着没有
的DNA
变化可以传递给后代。
 点击上方观看视频,了解更多关于血癌的信息。
点击上方观看视频,了解更多关于血癌的信息。
癌症是指一组涉及不受控制的疾病
细胞
生长。 目前,基于 CRISPR 的疗法主要针对治疗
血液癌
喜欢
白血病
和
淋巴瘤
.
T细胞
,更为人所知的是白细胞,被识别其他细胞为安全或威胁的受体所覆盖。 他们巡逻身体,杀死外来或危险的细胞。 在
CAR-T
免疫疗法,研究人员对患者的 T 细胞进行基因工程,使其具有识别患者癌细胞的受体,告诉 T 细胞进行攻击。
免疫系统受到高度调节,以避免攻击健康细胞。 一些 T 细胞受体充当“检查点”,决定是否发生免疫反应。 当 T 细胞 PD-1 受体与一种叫做
PD-L1
在另一个细胞上,它表示它是一个“安全”细胞,而 T 细胞不理会它。
癌细胞很聪明,经常将自己隐藏在这些分子安全信号中,诱使巡逻的 T 细胞无视它们。 研究人员正在使用 CRISPR 编辑 PD-1
基因
在 T 细胞中阻止它们制造功能性 PD-1 受体,这样它们就不会被癌细胞所愚弄。 这种免疫治疗方法被称为检查点抑制,它与 CAR-T 工程结合使用,为 T 细胞提供最大可能消除癌症的机会。
在这些治疗中,研究人员从患者的血液中采集 T 细胞,并在实验室中对其进行改造。 这是一种
体外
基因组编辑
,因为
基因组
编辑发生在患者体外。
离体
编辑保证基因组编辑工具只与正确的目标细胞接触。
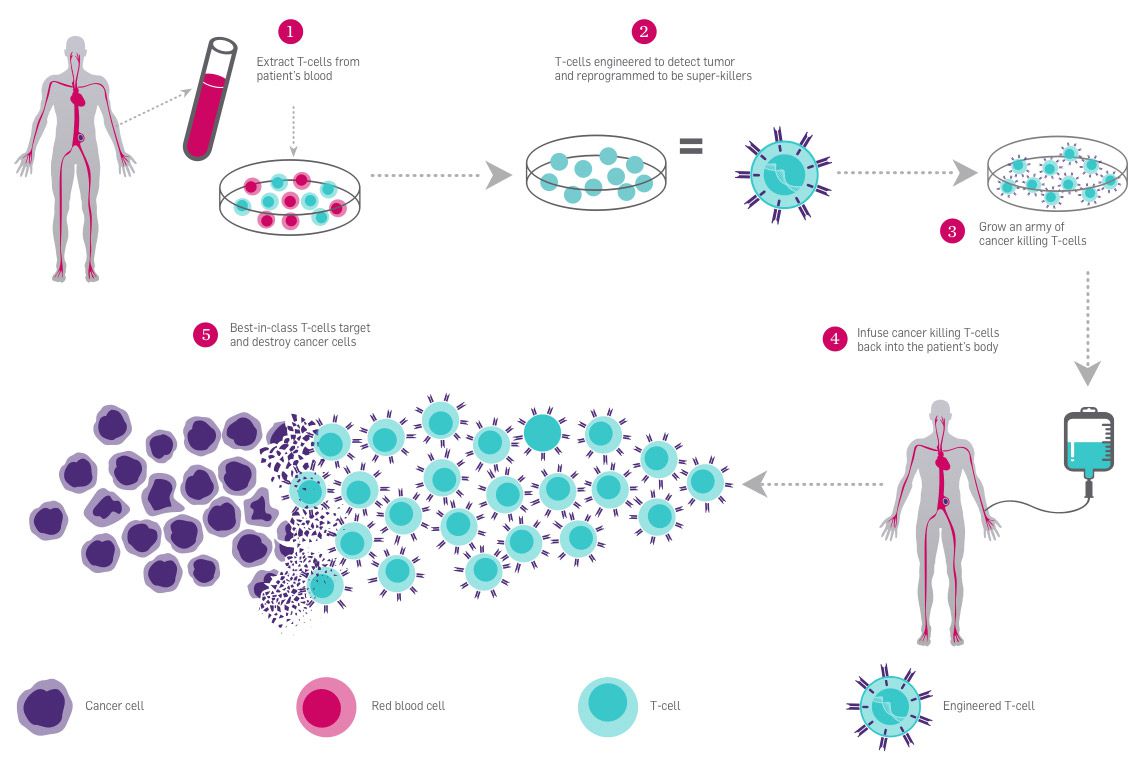 免疫治疗过程概述。 图片由
帕克研究所
.
免疫治疗过程概述。 图片由
帕克研究所
.
基因疗法面临的一大挑战是交付——即,将药物送到需要的地方,而且只在需要的地方。 血癌是 CRISPR 疗法的首要目标之一,因为传递是最直接的。 修饰的 T 细胞可以通过静脉注射进入血液,就像输血一样。
目前的临床试验
美国首个基于 CRISPR 的治疗试验
结合了 CAR-T 和 PD-1 免疫治疗方法。 这个
根据一项研究,
目前正在宾夕法尼亚大学与帕克研究所合作。 患者志愿者患有晚期癌症,几乎没有其他治疗选择。 至少
两个病人
已经接受了治疗,但我们还不知道结果。
测试 CRISPR 免疫疗法治疗癌症的临床试验可能早在 2015 年就在中国开始。 七项中国在研或招募试验在美国临床试验上市
数据库
. 虽然中国是
投入巨资
在 CRISPR 中,人们主要担心临床医生在没有适当临床试验的情况下继续前进
基础设施
, 监督, 安全预防措施,
知情同意
患者或研究
严格
. 中国一再出现问题
欺诈
临床试验数据。 来自活跃或已完成研究的数据很少发布。
需要注意什么
FDA已经批准
CAR-T
不使用基因组编辑的疗法和 PD-1 通路抑制剂。 这是乐观的理由:这些疗法的原理验证工作已经完成。
也就是说,还有很多需要注意的地方。 虽然可以使用抗体治疗来禁用 PD-1,但编辑 DNA 来禁用 PD-1 基因的功效尚未经过测试。 它会在多少百分比的细胞中起作用? 基因检查点抑制与当前的检查点阻断疗法一样有效吗?
这些试验还应该提供有关基于 CRISPR 的编辑的更广泛问题的见解:在 DNA 断裂位点会发生什么样的变化
Cas9
创造? 我们多久会看到
更大的 DNA 重排
超出预期? 会不会有重大的“
不中
“ 变化? 这些风险会被证明比收益更重要还是更不重要?
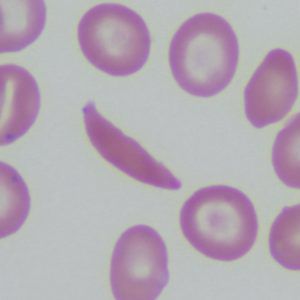 健康和镰状红细胞的图像。
健康和镰状红细胞的图像。
红细胞使用血红蛋白在肺部吸收氧气并将其输送到身体的所有组织。
突变
在构成血红蛋白分子一部分的基因中,会导致两种不同的遗传疾病:
β地中海贫血
和
镰状细胞病(SCD)
.
在β地中海贫血中,患者不能制造足够的血红蛋白。 这会导致贫血和疲劳。 在更严重的情况下,患者会出现器官损伤,尤其是肝脏、骨骼和心脏。 在镰状细胞病 (SCD) 中,红细胞畸形。 它们的新月形或镰刀形使它们阻塞血管,减缓或阻止血液流动。 这会导致突然的剧烈疼痛。 并发症包括慢性疼痛、器官损伤、中风和贫血。 这两种疾病都可能是致命的。
有一些可用的治疗方法,但这些患者仍然经常因疾病而出现严重的症状和并发症。 患者需要经常输血。 骨髓移植可以治愈; 然而,这是一个冒险的过程,只有在找到健康、匹配的捐赠者时才能进行。 这不是大多数β地中海贫血或 SCD 患者的选择。
当前针对血液疾病的 CRISPR 临床试验使用了一种巧妙的解决方法:而不是解决疾病——
导致突变,他们的目标是提高水平
胎儿血红蛋白。
这是胎儿在子宫内制造的一种血红蛋白,但儿童和成人通常不会制造。 我们不知道为什么人类会从一种形式的血红蛋白转变为另一种形式,但胎儿血红蛋白可以
代替
红细胞中有缺陷的成人血红蛋白。
 在 SCD 患者中,症状在胎儿血红蛋白水平下降后开始出现。
在 SCD 患者中,症状在胎儿血红蛋白水平下降后开始出现。
针对胎儿血红蛋白的相同基因治疗可用于治疗β地中海贫血和 SCD。 这种治疗的第一步是采集患者的血液
干细胞
从他们的血液中。 接下来,科学家们编辑这些细胞的基因组以打开胎儿血红蛋白。 然后,化疗去除患者剩余的有缺陷的干细胞,并将数十亿个基因组编辑的干细胞放回患者体内。 理想情况下,这些细胞将在骨髓中产生一个新的造血干细胞群,这将产生带有胎儿血红蛋白的红细胞。
基因编辑的造血干细胞可以通过静脉注射,以及
体外
编辑使向目标细胞提供基因组编辑工具变得容易。

在
第一次使用
体外
基于 CRISPR 的疗法治疗遗传疾病
, 研究人员至少治疗过
一名患者
在德国患有β地中海贫血症。 CRISPR Therapeutics 和 Vertex Pharmaceuticals 正在进行这项试验,
招聘
欧洲和加拿大的患者。
CRISPR治疗学
最近透露,编辑过的细胞似乎在他们的第一个病人身上起作用了!
在
第一次使用
体外
基于 CRISPR 的疗法在美国治疗遗传病
中,至少
一名患者
SCD 患者在田纳西州纳什维尔接受了相同的治疗。 该参与者的早期数据看起来很有希望; 你可以关注更新
点击此处
。 该
试用
正在美国、欧洲和加拿大招聘。
需要注意什么
现在,我们不知道这些治疗会有多有效。 需要注意的主要结果包括:成功编辑的单元格百分比是多少? 编辑过的干细胞在骨髓中的新家有多好? 编辑后的细胞会产生足够的胎儿血红蛋白来控制患者的疾病吗? 随着时间的推移,经过编辑的造血干细胞会持续存在还是被具有致病突变的细胞所取代?
现在,有大量关于血液疾病的研究。 其他制药和生物技术公司正在研究标准疗法和基因疗法。 我们还不知道哪种方法最有效,但患者肯定会从对这些疾病的重新兴趣中受益。
 圣地亚哥·拉蒙·卡哈尔 (Santiago Ramón y Cajal) 的视网膜经典图画。
圣地亚哥·拉蒙·卡哈尔 (Santiago Ramón y Cajal) 的视网膜经典图画。
Leber 先天性黑蒙 (LCA) 是遗传性儿童失明的最常见原因。 LCA10 是最常见的 LCA 形式。 这种遗传疾病会在生命的最初几个月内导致严重的视力丧失或失明。
眼睛中的感光细胞将光转化为神经信号,然后传递到
脑。 在 LCA10 中,光感受器基因的突变使关键基因的缩短、有缺陷的版本
蛋白质
,使感光细胞功能失调。 LCA10 患者的眼睛可以接收光线,但功能失调的感光细胞不会向大脑发送信息。 如果眼睛和大脑之间没有交流,患者就会出现视力下降或失明。
LCA10 的 CRISPR 治疗改变了患者有缺陷的光感受器基因,使其再次产生全尺寸的功能性蛋白质,而不是短的、破碎的版本。 如果足够多的细胞被编辑并可以制造出健康的蛋白质,患者应该会恢复视力。
研究人员将通过将 CRISPR 疗法直接注射到患者的眼睛中,为患者志愿者提供单剂量的 CRISPR 疗法。 注射液具有非致病性
病毒
(
AAV
) 携带 Cas9 蛋白及其
向导RNA
.
病毒
常用于
基因治疗
和基因组编辑,因为它们具有进入细胞的天然能力。 对于 LCA10 治疗,
病毒
载体经过精心设计,因此该疗法仅在感光细胞中有效。
这种方法不同于那些正在接受癌症和血液疾病测试的方法,因为它是一种
体内
治疗,基因组编辑发生在患者体内。 相比
体外
编辑,
体内
编辑面临更大的挑战和风险。 最大的风险之一是病毒递送工具或基因组编辑部件会在患者体内引发危险的免疫反应。 另一个重大挑战是确保 CRISPR
酶
不要停留太久,因为这会给他们更大的机会切入 DNA 中不需要的位置。
想到眼睛附近的针,你可能有点拘谨,但眼睛实际上是一个理想的器官
体内
编辑。
它相对较小,因此只需要小体积的单剂量治疗。 眼睛少了
免疫反应
与大多数组织相比,不太可能发生危险的免疫反应。 由于眼睛相对封闭,CRISPR 组件不太可能传播到身体的其他部位,因此在其他组织中发生不需要的基因组编辑或免疫反应的风险较小。
FDA 已批准对这种 LCA10 治疗进行人体测试。 这将会
第一位
体内
CRISPR疗法试验
. Editas Medicine 正在运行这个
试用
与 Allergan 合作,他们目前正在美国各地招募患者志愿者。
需要注意什么
研究人员将需要密切跟踪患者,以查看除
感光细胞受到影响,或者患者对治疗有免疫反应。 其他关键研究问题包括:多少百分比的细胞将得到有效编辑? 是否足以恢复视力?
如果治疗有效,这将是直接修复遗传疾病的首次证明。 传统的基因疗法,例如用于
“泡泡男孩病”
通过添加一个额外的基因来工作——而不是修复原始的、有缺陷的基因。 同样,针对 β 地中海贫血和 SCD 的 CRISPR 疗法不能修复原始的致病突变。 这项试验的成功将是遗传医学向前迈出的重要一步。
大局:我们希望从这些试验中学到什么
综上所述,这些试验应该可以帮助科学家了解
DNA变化
CRISPR 酶使用不同的递送方法在各种不同的组织类型中引起。 是否存在不需要的变化,例如大段 DNA 被切除或染色体片段被重新排列? 我们可以假设在某种程度上会发生不需要的变化,但它们会对患者产生有意义的影响吗? 与所治疗疾病的严重程度相比,这些问题有多大?
这些试验的共同点是易于递送选项和对 CRISPR 组件产生危险免疫反应的风险低——这些疗法之所以成为首要,是因为有针对这些技术挑战的便捷解决方案。 下一个是什么?
更多医学 CRISPR 首创需要注意
虽然这些试验令人兴奋,但癌症免疫疗法和通过增加治疗血液疾病的先例
胎儿血红蛋白
– 这些并不是依赖于 CRISPR 的全新治疗方法。 此外,他们依赖于对 CRISPR 来说非常容易的 DNA 进行编辑——
CAS号
酶——它们并不是对 CRISPR 技术本身可以做什么的真正主要测试。 在了解 CRISPR 潜力的进一步发展方面,我们将从未来的里程碑中学到很多东西:
-
A
涉及插入 DNA 的 CRISPR 治疗
修复或更换错误序列——在新材料中“粘贴”仍然是一个重大挑战。
-
A
使用 CRISPR 工具在不编辑 DNA 的情况下打开和关闭基因的试验
. 这些策略被称为
CRISPR 激活和抑制
,不需要破坏患者的 DNA,因此它们可能更安全。 然而,目前尚不清楚它们对人类的影响会持续多久。
-
A
一次修复多个基因的CRISPR疗法
. 许多重大疾病,如糖尿病和心脏病,都是“
多基因的
,”意味着多个基因在它们的进展中发挥作用。 虽然科学家们取得了令人印象深刻的成就
在孤立
细胞和动物模型
,我们距离对真实患者的基因组进行多次改变还有很长的路要走。
-
An
体内
使用非病毒传递的 CRISPR 试验
– 当前的技术依赖于病毒传递,这会引发免疫反应或将病毒 DNA 插入基因组中。 这些病毒的小承载能力也限制了可以做的事情,因为单个 CRISPR 酶基因加上它的向导
RNA
通常占据大部分货物空间。 研究人员正在开发替代递送策略,从纳米粒子
和
核糖核酸
至
外来体
超越。
有关临床试验的更多信息
如果您或您所爱的人有兴趣参与临床试验,您可以了解有关美国临床试验如何运作的更多信息
点击此处
并搜索当前的试验
点击此处
. 始终与您的医生讨论重要的医疗决定。 请记住,临床试验是对人类新医学治疗的首次测试,因此它们对患者具有内在的风险,并且永远不能保证成功。



